合作客戶/
拜耳公司 |
同濟大學 |
聯合大學 |
美國保潔 |
美國強生 |
瑞士羅氏 |
相關新聞Info
應用熒光顯微鏡研究了蛋白質在氣-水界面的組裝——摘要、介紹
來源:上海謂載 瀏覽 1144 次 發布時間:2021-12-14
摘要
空氣-水界面(AWI)上的蛋白質組裝在許多生物過程中自然發生,并提供了一種制造生物材料的方法。然而,在AWI中控制蛋白質自組裝的因素以及吸附過程中發生的動力學過程仍然沒有得到充分的探索。利用熒光顯微鏡,我們研究了在AWI處組裝的一種模型蛋白,即用德克薩斯紅色熒光團最低限度標記的人血清白蛋白。在低亞相濃度下獲得靜態和動態信息。通過改變溶液蛋白質濃度、離子強度和氧化還原狀態,我們相應地改變了AWI處蛋白質組裝的微觀結構。pluronic表面活性劑的加入導致AWI發生相分離,通過光漂白實驗后的熒光恢復顯示出流體表面活性劑結構域和更堅硬的蛋白質結構域。在這一競爭吸附過程中,觀察到蛋白質結構域聚結。
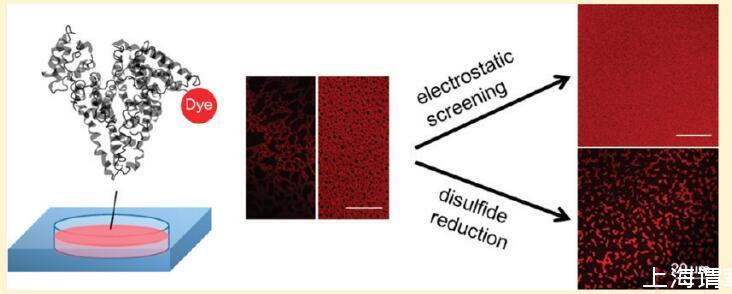
1.介紹
眾所周知,蛋白質在空氣-水界面(AWI)的行為在食品科學中對于增強泡沫穩定性和蛋白質結晶以指導有序組裝具有重要意義。1,2它在許多生物技術應用中也具有相關性,例如,蛋白質溶液在平面上的行為以及在流體設備中的行為,其中蛋白質吸附在固體水和空氣-水界面上都非常重要。3在醫學上,肺表面活性物質和血清蛋白在肺泡水襯里層上的競爭性吸附因其在急性呼吸窘迫綜合征中的作用而被廣泛研究。4,5在氣體栓塞中也很重要,在血液中,氣泡可以將蛋白質吸收到其表面,并導致流向受影響區域的血流和氧氣輸送減少(即栓塞)以及凝血。6對這些過程的干預或操縱需要對蛋白質在AWI形成的組裝有更深入的了解。
從另一個角度來看,AWI是一種獨特的工具,用于將蛋白質作為小的構建單元引導到更大的自組裝結構中。蛋白質是天然存在的生物聚合物,具有非對稱分布的掩埋和溶劑暴露的活性位點、靜電電荷和疏水/親水殘基。這些特征,再加上幾何約束,決定了折疊蛋白質及其較大組裝體的結構。組裝復雜的生物或合成系統的一種策略是促進一個或兩個維度的相互作用。液體界面在這方面特別有用,因為其中存在各向異性力和二維空間限制。7-9除了液體界面的特殊特性外,通常控制自組裝的因素是構建塊的化學和結構互補性。10對于蛋白質等大分子,其活性部位、幾何結構以及靜電和疏水相互作用受到周圍溶劑分子和其他溶質的極大影響。11,12因此,溶液條件為在AWI處控制蛋白質組裝提供了方便的手柄。
先前的張力測定法、反射測定法和橢偏測定法研究了AWI中蛋白質的表面過剩變化和結構構象與溶液條件(如亞相濃度、pH值和離子強度)的關系。13-16這些技術在宏觀尺度上提供了吸附蛋白質的整體平均特性。為了在納米到微米尺度上研究AWI的組裝結構,已經應用了原子力顯微鏡(AFM)、布魯斯特角顯微鏡(BAM)和熒光顯微鏡等成像技術。17-19 AFM提供納米空間分辨率,但涉及將界面膜轉移到固體表面,這導致結構保真度和時間分辨率的損失。17 BAM與Langmuir槽耦合是一種廣泛使用的原位方法,但其空間分辨率(2μm)低于許多衍射受限光學成像技術,且動力學信息很少。18,20 Fujita等人對AWI的疏水螺旋肽組裝21和Gluck等人對多糖吸附22的開創性研究表明,熒光顯微鏡有可能作為研究AWI大分子自組裝的簡易原位成像工具。通過這種技術,Powers等人發現了在AWI上自組裝的兩親性肽的中等依賴性微米級相域。23在這項具有里程碑意義的研究中所做的觀察尚未推廣到蛋白質系統。在這里,我們首次證明了通過系統地改變溶液條件來控制AWI蛋白質自組裝微觀結構的能力。
本研究以得克薩斯紅標記的人血清白蛋白(HSA-TR)為模型蛋白,在不同溶液條件下用原位熒光顯微鏡研究了其自組裝的微觀結構。人血清白蛋白(HSA)提供了一個有用的模型蛋白質系統,因為它的生物物理性質已經在溶液中和AWI中得到了很好的研究。16,24其相關性來自于一個事實,即HSA是人體血漿中最豐富的蛋白質(3.5-5.0 g/dL),用于維持血漿脹亡壓和轉運配體。當氣體栓塞進入血管時,血漿蛋白(如HSA)在氣體-血液界面吸附和聚集。25這些界面蛋白層被懷疑會影響氣泡與內皮表面的粘附,并通過與內皮或血小板表面上的大分子相互作用引發血液凝結。26
HSA由一條含有585個氨基酸的多肽鏈組成,其中包括35個半胱氨酸和59個賴氨酸。三十四個半胱氨酸形成17個分子內二硫鍵,單一的反應性Cys34對氧化還原狀態極為敏感。24,27 X射線結晶學證實HSA具有α-螺旋二級結構,并在生理條件下鑒定出一個心形或等邊三角形三級結構,一側80?,厚度30?。24反射計研究還發現界面處的血清白蛋白層厚度為30-40?,但蛋白質被近似為一個橢球體,長軸平行于界面140?,垂直短軸為40?。16光譜和流變學方法先前已在AWI處發現單層HSA粘彈性膜,蛋白質保留其二級結構。16,28,29
目前的研究應用原位熒光顯微鏡在一個小型成像室中研究AWI處的蛋白質組裝~10μL溶液,同時限制液-固界面上的競爭性蛋白質吸附。形成了一個穩定的界面,蒸發量可以忽略不計,這使得在亞微米的空間分辨率和毫秒到小時的時間尺度上可以獲得AWI處蛋白質行為的靜態和動態信息。我們的結果揭示了在AWI形成的微尺度蛋白質組裝,并強調了溶液條件在控制組裝結構中的作用。還觀察到AWI處的相分離動力學轉變。
應用熒光顯微鏡研究了蛋白質在氣-水界面的組裝——結論、致謝!










