合作客戶/
拜耳公司 |
同濟大學 |
聯合大學 |
美國保潔 |
美國強生 |
瑞士羅氏 |
相關新聞Info
通過調節薄脂蛋白膜的親水性非表面活性聚合物的表面性質
來源:上海謂載 瀏覽 901 次 發布時間:2022-08-18
摘要
我們研究了親水聚合物(HPs)逆轉白蛋白抑制作用和恢復脂質蛋白肺表面活性劑制劑(LSP)表面活性的能力:Curosurf和Survanta。暗示的HPs是葡聚糖和聚乙二醇10000(PEG1000)。在空氣/水界面的薄膜(單層和泡沫)中評估LSP的表面活性。白蛋白從界面上取代LSP,并抑制其在單層中維持低表面張力和形成穩定的泡沫薄膜(FF)的能力。當HPs添加到單層中時,它們恢復LSP的表面活性并恢復其維持低動態表面張力的能力。類似地,泡沫膜中HPs的加入導致白蛋白效應的中和,并形成具有均勻表面的穩定薄膜(厚度<17 nm),如純LSP的情況。我們的發現允許我們尋找一個有趣問題的答案,為什么PEG更好地恢復了Survanta的表面活性,而葡聚糖-則恢復了Curosurf的表面活性。這些結果可能對成人呼吸窘迫綜合征的治療具有重要意義。
介紹
肺表面活性物質(LS)是一種復雜的脂質-蛋白質混合物,在肺泡表面形成各種薄膜。它的主要功能之一是在呼氣時壓縮肺表面時達到較低的表面張力,并防止肺泡塌陷。
許多外源表面活性劑制劑(ESP)能夠在純空氣/水界面快速吸附并降低其表面張力。由于其高表面活性,這些制劑在治療特發性呼吸窘迫綜合征(一種新生兒患有表面活性劑不足且肺泡空氣/水界面“純凈”且“開放”以補充表面活性劑的疾病狀態)方面是有效的。然而,最近另一種病理學正在增加其發病率:所謂的成人呼吸窘迫綜合征(ARDS)。在ARDS患者中,肺泡內發生血液滲漏,空氣/水界面被吸附的血漿蛋白,尤其是最豐富的血液蛋白血清白蛋白“阻斷”。目前可用的ESP對于ARDS治療是無效的,因為它們不能從表面置換白蛋白分子,并且不能吸附和降低表面張力。因此,迫切需要找到一種調整ESP界面性質的方法,以恢復藥物制劑在白蛋白存在下的表面活性。
在目前的工作中,我們研究了兩種ESP(Survanta和Curosurf)在被吸附的牛血清白蛋白(BSA)阻擋的空氣/水界面的薄膜中的表面行為。所采用的薄膜是單層和泡沫膜。單層張力測定法用于測量表面活性劑制劑壓縮單層表面積后獲得的最小表面張力γmin。泡沫膜(FFs)由兩個相互粘附的頭對頭脂質蛋白單層組成。雖然FFs被認為是(1)體外評估肺表面活性物質制劑界面性質的有力工具,但這是FFs首次用于研究白蛋白對ESP表面行為的影響。
ESP使用純的且在非表面活性親水聚合物(HPs)葡聚糖和聚乙二醇10000(PEG1000)存在下。選擇這些HPs是因為它們被認為通過正耗盡吸引滲透壓的機制防止白蛋白誘導的表面活性劑抑制(2)。
材料和方法ESP(Survanta和Curosurf)從生產商處獲得。NaCl、牛血清白蛋白(BSA)、PEG 10000和右旋糖酐(Mw 79 400)購自“西格瑪”。所有溶液均采用超純去離子水(電導率小于0.1μS)制備。
單分子膜在朗繆爾槽(表面積118 cm2)中形成單分子層,并使用微槽X張力計(Kibron Inc.,芬蘭)使用鉑絲探針通過Wilhelmy方法測量表面張力。使用兩種亞相:(i)表面張力為72.9mN/m的純鹽水溶液——用于純空氣/水界面的對照實驗;(ii)表面張力約為50mN/m、溶解白蛋白(2mg白蛋白/ml)的鹽水溶液。當暗示葡聚糖或PEG 10000時,它們在亞相中溶解至5%的最終濃度。在該量下,HPs不會改變溶液的表面張力。通過Hamilton microsyringe將ESP制劑(在沒有和存在HPs的情況下)作為脂質體懸浮液分散在空氣/水界面上。大約用了一個小時來準備在界面上傳播。然后進行十次連續的面積壓縮/減壓循環,其中單層被壓縮在118cm2(初始表面積)和23.6cm2(初始表面面積的20%)之間。壓縮速度為140mm/min。記錄了在最小單層表面積下獲得的最小表面張力γmin(mN/m)。
泡沫膜如前所述(3),在Scheludko和Exerowa的測量池中形成微觀泡沫膜。通過倒置光學顯微鏡觀察它們,并通過干涉測量技術測量膜厚度h(nm)。FFs的照片由Olimpus C-7070寬變焦相機拍攝。
結果和討論
單層
當在純空氣/水界面擴散時,ESP、Curosurf和Survanta在十個區域壓縮/減壓循環中達到并保持低于10 mN/m的最小表面張力(圖1)。
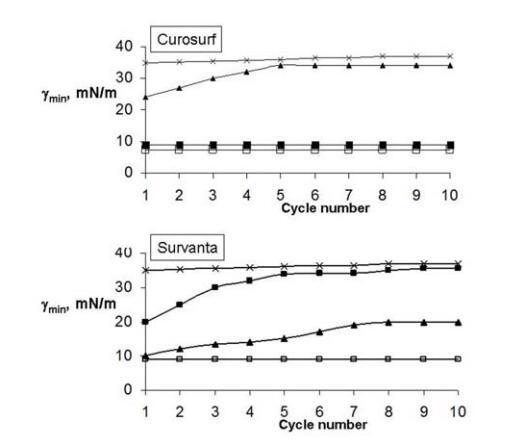
圖1.Curosurf(上圖)和Survanta(下圖)單層的最小表面張力(γmin)對壓縮/減壓循環次數的依賴性。符號表示:□-純空氣/水界面處的ESP(鹽水溶液亞相上);在BSA亞相上的x-ESPs(2mg/ml);■-在BSA(2mg/ml)和5%葡聚糖的亞相上進行ESPs;▲-在BSA亞相(2mg/ml)和5%PEG 10000上進行ESP。ESP作為脂質體懸浮液擴散,最終濃度為15μg磷脂/ml。實驗在0.15 M NaCl、pH 6.8-7.0、T=25℃下進行。
白蛋白的存在損害了制劑的表面性質,兩者的γmin約為30mN/m。單層亞相中HPs的存在允許恢復ESP維持低γmin值的能力。葡聚糖在恢復Curosurf的表面活性方面比PEG 10000更有效(圖1上圖)。可以看出,在PEG存在下,Curosurf在第一次壓縮/減壓循環期間達到20mN/m的最小表面張力,該最小表面張力隨著循環次數不斷增加,直到達到大于30mN/m。相反,當葡聚糖包含在亞相中時,Curosurf表現出與純空氣/水界面相同的行為,并在所有連續循環中保持γmin=9 mN/m。
與上述結果相反,在Survanta的情況下,PEG 10000比葡聚糖更有效(圖1下圖)。在葡聚糖存在下,Survanta獲得了20mN/m的γmin(第一次循環),在隨后的循環中增加到30mN/m以上。PEG的加入允許Survanta在第一次循環中達到9 mN/m的最小表面張力(與純空氣/水界面處的值相同),盡管在隨后的循環中(第8次至第10次循環)它上升到20 mN/m的平臺值。有必要將Survanta的體積濃度增加到200μg PL/ml,以便在所有壓縮/減壓循環期間保持約10mN/m的γmin(數據未顯示)。
純空氣/水界面處的泡沫膜Curosurf形成厚度為15 nm的穩定普通黑色膜,而Survanta形成由薄黑色區域(h=17 nm)組成的異質FFs,其中較厚區域被困在膜內(圖2)。向ESPs中添加HPs不會改變在純空氣/水界面處形成的黑色膜的類型和厚度。

圖2 ESPs形成的普通黑色薄膜。實驗在250μg磷脂/ml 0.15 M NaCl、pH 6.8-7.0、T=25℃下進行。
當白蛋白存在于膜芯中時,ESP形成黑色膜的能力受到抑制,并形成厚(h>100nm)異質膜(圖3A和4A),類似于由純白蛋白溶液形成的FFs。
通過Curosurf和白蛋白將PEG 10000包含到混合FFs中不會改變膜類型,并且FFs仍然厚且不均勻。相反,葡聚糖的加入導致了顯著的變化:觀察到薄膜變薄且穩定的黑色薄膜(h=15 nm),類似于在沒有白蛋白的情況下通過Curosurf獲得的薄膜(圖3)。
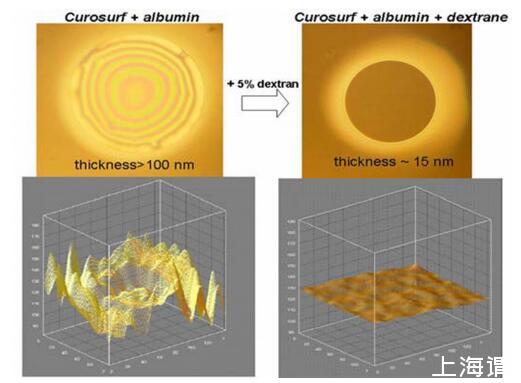
圖3.在250μg磷脂/ml、0.15 M NaCl、pH 6.8-7.0、T=25℃條件下,通過Curosurf和BSA進行混合FFs以及添加葡聚糖對膜形態的影響實驗。
當通過Survanta和白蛋白添加到混合FFs中時,葡聚糖不會改變膜的性質。然而,當FFs中包含PEG 10000時,富含白蛋白的厚膜分解成更小的厚“島”,島之間有薄的(h=17 nm)黑色區域(圖4)

圖4.通過Survanta和BSA的混合FFs以及PEG 10000添加對膜形態的影響。黑色區域的厚度為17nm。實驗在250μg磷脂/ml、0.15 M NaCl、pH 6.8-7.0、T=25℃下進行。
討論和結論
白蛋白抑制外源表面活性劑制劑在空氣/水界面的表面活性。當BSA出現在膜液相中時,Curosurf和Survanta都失去了在單層中保持低最小表面張力和形成黑色泡沫膜的能力。
通過ESP和白蛋白將親水聚合物包含在混合薄膜中,恢復了藥物制劑的表面活性,ESP從空氣/水界面置換了白蛋白。后者導致(i)單分子膜中ESP低γmin值的恢復,以及(ii)ESP形成黑色泡沫膜的能力的恢復。
值得注意的結果是,兩種親水性聚合物葡聚糖和PEG 10000在BSA存在下恢復ESPs表面性能的效率不同:葡聚糖對Curosurf更有效,PEG 10000-對Survanta更有效。這表明HP的影響不僅可以用正滲透壓來解釋,還可能與聚合物對本體表面活性劑聚集體結構的不同影響有關(4)。
當前工作的重要影響是首次實施自由流,以研究白蛋白和親水聚合物對ESP表面行為的影響。
致謝
我們感謝保加利亞教育和科學部撥款DVU01/0406提供的財政支持。










